هوش مصنوعي، كريسپر و جراحي رباتيك در حال تغيير مراقبتهاي بهداشتي هستند و به پزشكان و بيماران اجازه ميدهند در تشخيص و درمان بيماري بهتر عمل كنند.
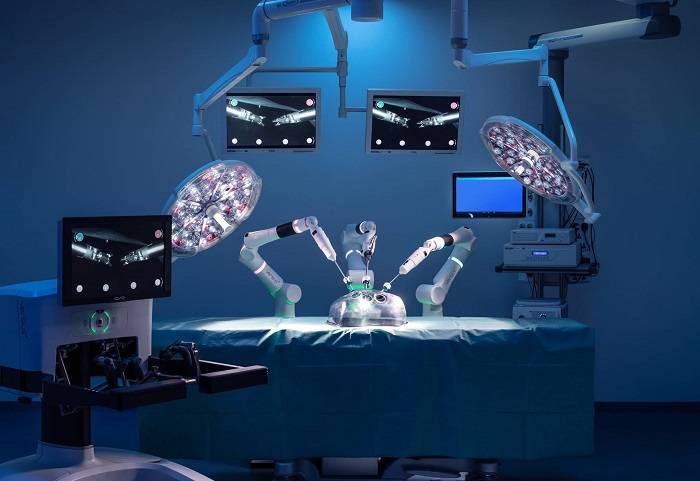
حاصل تلاش اسلك و همكارانش ورسيوس است؛ ربات جراح كه به منظور كمك جراحي به روش سوراخ كليد (جراحي با ايجاد برش كوچك) طراحي شده است.
اسلك ميگويد جراحي به روش سوراخ كليد عموما به جراحي باز ارجحيت دارد. بهطور كلي، اگر بهجاي جراحي باز، از جراحي روش سوراخ كليد استفاده شود، حدود ۵۰ درصد از عوارض پس از جراحي كاهش پيدا ميكند. وي ميگويد: «اگر زخم كوچكي با حداقل دسترسي داشته باشيد، تقريبا هيچيك از بيماران به بيمارستان برنميگردند. اگر زخم بزرگي داشته باشيد، احتمالا حدود يكپنجم بيماران به علت عفونت زخم به اتاق عمل بازميگردند.»
بهگفتهي اسلك، مشكل اين است كه كمتر از ۵۰ درصد از بيماران در سراسر جهان از مزيت جراحي با حداقل دسترسي بهرهمند ميشوند؛ زيرا اين روش جراحي از نظر فني دشوار و براي جراح طاقتفرسا است. اسلك ميگويد: «پس از سالها آموزش جراحان به روش حداقل دسترسي، متوجه شدم بسياري از افراد بهراحتي نميتوانند در آن مهارت پيدا كنند.»
رباتيك راهحل بالقوهاي ارائه ميدهد. ورسيوس چند بازو دارد كه هر يك داراي هفت درجه آزادي است و به جراح اجازه ميدهد رويههايي انجام دهد كه به كمك لاپاراسكوپي استاندارد ممكن نيست. ربات همچنين به ديد سهبعدي مجهز است كه به جراحان كمك ميكند تتجسم بهتري از ميدان جراحي پيدا كنند و بتوانند رويههاي پيچيدهتر را انجام دهند.
اسلك اميدوار است ورسيوس بسياري از مشكلات پيش روي جراحي امروز را حل كند. براي مثال، هر سال هزاران بيمار براثر عوارض پس از جراحي آسيب ميبينند. وي ميگويد: «جراحي با حداقل دسترسي عوارض را حدود ۵۰ درصد كاهش ميدهد. علاوهبراين، اگر بتوانيم جراحي را استاندارد كنيم، عوارض كاهش بيشتري نيز پيدا ميكند.»
جراحي رباتيك از جراحي بهوسيلهي انسانهاي ماهر مزاياي بيشتري دارد. اين روش يك رابط ديجيتال بين بيمار و جراح ايجاد ميكند و ميتواند بهطور مداوم دادههاي مهم را جمعآوري كند كه در غير اين صورت از دست ميروند: تجزيهوتحليل تصوير، حركات كاربر، دوريسنجي از ابزارهاي رباتيك و موارد ديگر. اسلك ميگويد: «رابط ديجيتال به ما اين توانايي را ميدهد كه حركات دست جراح را بررسي كنيم. اكنون دادههايي داريم كه به ما نشان ميدهند چگونه ميتوان تفاوت كاربر تازهكار و ماهر را تشخيص داد. اين بدان معنا است كه ميتوانيم جراحاني كه عادات بدي دارند و شايد از برخي جهات، از ربات بيشازحد استفاده ميكنند، شناسايي و روشهايي اتخاذ كنيم كه براي بيمار بهتر باشد.»
شركت CMR همچنين آموزشدهندهي ورسيوس را ساخته است؛ شبيهسازي كه جراحان ميتوانند از آن براي آشنايي با دستگاه استفاده كنند. اپليكيشني كه مايورسيوس نام دارد، ويدئوهايي ذخيره ميكند كه جراحان ميتوانند آنها را براي بهبود رويههاي جراحي خود تجزيهوتحليل كنند. اسلك ميگويد: «اين امر آنها را قادر ميسازد تا دفترچه يادداشت ديجيتال داشته باشند و خود را با بهترين رويهها محك بزنند. اين همچنين بدان معنا است كه جراحان (اگر نتايج كمي بدي داشته باشند) بهراحتي به مسير درست برگردند؛ زيرا ميتوانند از ديگران كمك بگيرند و ببينند چرا نتايج آنها ضعيف شده است.»
در حال حاضر فقط ۵ تا ۷ درصد از كل جراحيها بهصورت رباتيك انجام ميشود. ورسيوس در بيش از ۸۰۰ عمل جراحي و بيمار در چندين مكان در سراسر جهان و بهوسيلهي چهار بيمارستان NHS (سرويس سلامت همگاني بريتانيا) و نيز در هند و مناطق ديگر اروپا مورد استفاده قرار گرفته است. اسلك ميگويد: «معتقدم طي پنج سال آينده شاهد شتاب عظيمي در جراحي رباتيك خواهيد بود؛ تا جايي كه جراحي رباتيك كاملا جاي رويههاي لاپاراسكوپي دستي را خواهد گرفت.»
البته رباتهاي جراح تنها دستاوردهاي بزرگ فناوري نيستند كه مراقبتهاي بهداشتي را دگرگون ميكنند؛ بلكه پيشرفتهاي بزرگ ديگري در اين حوزه وجود دارد كه در ادامه به آنها ميپردازيم.
استفاده از كريسپر براي حذف بيماري از DNA
دو هفته قبل از دريافت جايزه نوبل شيمي سال ۲۰۲۰، جنيفر دودنا (بيوشيميدان) از خانه خود در كاليفرنيا با وايرد هلث صحبت كرد تا در مورد كشف خود از تكنيك ويرايش ژن كريسپر صحبت كند كه او آن را به «جراحي مولكولي» تشبيه ميكند. او گفت:
كريسپر در واقع راهي براي تغيير DNA در سلولها و موجودات است و تصحيح دقيق جهشهاي عامل بيماري را ممكن ميسازد. كريسپر همچنين به دانشمندان امكان ميدهد تا انواع دستكاري ماده ژنتيكي را در سلولها و موجودات زنده انجام دهند. آنها ميتوانند به كمك كريسپر جزئيات ذخيرهشده در ژنوم هر نوع سلول و هر موجود زنده را تغيير بدهند و به ما امكان ميدهد تا آن اطلاعات را درك و دستكاري كنيم.
بهگفتهي دودنا، توسعهي كريسپر از حوزهي پژوهشي گمنامي آغاز شد كه به مطالعهي نحوهي مبارزهي باكتريها با عفونتهاي ويروسي ميپردازد. در باكتريها، CRISPR-Cas9 نوعي سيستم دفاعي است كه ايمني فراهم ميكند. او ادامه داد:
آنها اين كار را با ايجاد ضبط مولكولي كوچكي از ويروس با استفاده از DNA ويروسي انجام ميدهند. سلول قطعهاي از DNA ويروسي را در بخشي از DNA باكتريايي ذخيره ميكند كه «جايگاه كريسپر» ناميده ميشود. سپس DNA ذخيرهشده الگويي براي ساخت مولكولهاي RNA فراهم ميكند كه براي پيدا كردن و تخريب DNA داراي توالي مطابق با آن، ساخت پروتئينهايي به نام پروتئينهاي همبسته با كريسپر را هدايت ميكنند. به اين ترتيب، سلول يك كارت واكسيناسيون ژنتيكي ايجاد ميكند كه به او اجازه ميدهد از نظر مولكولي، ويروسهايي كه در گذشته آن را آلوده كردهاند، به خاطر داشته باشد و در صورت مواجهه با آنها در آينده، محافظت فراهم كند.
بهگفتهي دودنا، آنچه از آن پژوهش حاصل شد، پي بردن به اين واقعيت بود كه كريسپر توانايي ايجاد تغييرات دقيق در DNA دارد. دودنا ميگويد: «اين واقعا آغاز عصر ويرايش ژنوم به روش كريسپر بود. ما اكنون تكنيكي داريم كه بهراحتي در دسترس دانشمندان سرتاسر جهان است.»
يكي از كابردهاي كنوني كريسپر در بيماري سلول داسيشكل (بيماري ناشي از جهش ژن كدكنندهي پروتئيني براي هموگلوبين) است. در بيماران دچار جهش، اين نقص موجب تشكيل سلولهاي قرمز خون داسيشكلي ميشود كه مسير عبور خون را ميبندند.
اخيرا چند شركت كارآزماييهاي باليني استفاده از كريسپر براي درمان بيماري سلول داسي را آغاز كردهاند. دودنا ميگويد: «يك بيمار تحت كريسپردرماني براي بيماري سلول داسي قرار گرفت و بيماري او بهطور مؤثري درمان شد. اين امر موجب هيجان زيادي شد و دانشمندان را به اين فكر انداخت كه چگونه ميتوان از اين فناوري براي درمان بيماراني كه دچار اين بيماري يا ديگر بيماريهاي ژنتيكي نادر هستند، استفاده كرد.» دودنا فكر ميكند بيماريهاي ديگري مانند ديستروفي عضلاني بهزودي از كاربرد كريسپر بهرمند شوند. او ميگويد: «حدس ميزنم طي پنج سال آينده، بتوانيم درمورد كارآزماييهاي باليني و شايد نتايج واقعي صحبت كنيم.»
فناوري كريسپر همچنان آزمايشي و گران است و هنوز نميتواند بخشي از گزينههاي معمول درماني هر فردي باشد؛ اما دودنا خوشبين است كه روزي اين اتفاق خواهد افتاد.
اخيرا دانشمندان از كريسپر بهعنوان ابزاري براي تشخيص بيماري استفاده كردهاند. بهگفتهي دودنا، برخي از پروتئينهاي كريسپر اين توانايي را دارند كه توالي هدفي مطابق با توالي RNA راهنما را شناسايي كنند. او ميگويد: «از اين سيستمها ميتوان براي شناسايي ويروسها استفاده كرد.» او همچنين معتقد است كه در ماههاي آينده روشهاي تشخيصي مبتني بر كريسپر قابل استفاده در بالين بيمار، براي تشخيص سريع كوويد ۱۹ ارائه خواهد شد. دودنا ميگويد كريسپر كاربردهاي مختلفي ميتواند داشته باشد: از پژوهشهاي پايهاي در سلولها گرفته تا توسعهي داروها و آنتيبيوتيكهاي جديد، كشت محصولات مغذي و ايجاد محصولات كشاورزي مقاوم دربرابر بيماري.
رقابت براي ساخت واكسني عليه كوويد ۱۹
در اكتبر ۲۰۲۰، بيش از ۱۹۰ واكسن كوويد ۱۹ درحال ساخت و حدود ۴۰ مورد از آنها در مرحلهي آزمايش انساني بودند. طلايهدار اين رقابت، شركت آمريكايي مدرنا و شركت آلماني بيوانتك هستند. تال زاكس، مدير ارشد پزشكي مدرنا، ميگويد: «انتقال بالاي عفونت، پارادوكس ساخت واكسن است. هرچه وضعيت انتقال بدتر باشد، سريعتر متوجه خواهيم شد كه واكسن مؤثر است.» اين موضوع يكي از دلايلي است كه واكسني عليه ويروسهاي كروناي ديگر مانند سارس و مرس وجود ندارد: تعدادي كافي از افراد به ويروس آلوده نشدند. چنين چيزي درمورد كوويد ۱۹ وجود ندارد. زاكس افزود: «اگر كسي آلوده نميشد، هرگز متوجه نميشديم كه واكسن مؤثر است. هرچه موارد عفونت بيشتر و انتقال بالاتر باشد، سريعتر ميتوانيم نشان بدهيم كه واكسنها واقعا ايمن و مؤثر هستند.»
در كارآزمايي باليني مرحله سوم واكسن بيوانتك بيش از ۴۴ هزار نفر شركتكننده حضور داشتند. مدرنا نيز با همكاري NIH كارآزماييهاي مرحله سوم را با ۳۰ هزار شركتكننده انجام داد. نتايج حاصل از كارآزماييها چنين بود: نرخ كارآيي واكسن بيوانتك به ۹۰ درصد ميرسيد و مدرنا كارآيي حدودا ۹۵ درصد داشت. هر دو شركت در زمينهي درمانهاي مبتني بر RNA پيامرسان پيشرو هستند كه از مولكولي استفاده ميكند كه ميتواند اطلاعات ژنتيكي را رمزگذاري كند. اوغور شاهين، همبنيانگذار و مديرعامل شركت بيوانتك، ميگويد: «دانشمندان ميتوانند بخشي از ويروس را كه براي ايجاد پاسخ ايمني مؤثر و قوي اهميت دارد، بگيرند، آن را در قالب RNA پيامرسان رمزگذاري كنند و به شكلي به بدن تحويل بدهند كه سلولهاي انسان بتواند آن را جذب كند.» در نتيجه، اين سلولها واكسن توليد ميكنند. بهگفتهي شاهين، اين روش براي ايجاد پاسخ ايمني در بيماران، بسيار دقيق است. زاكس ميگويد: «حُسن روش آن است كه از ويروس استفاده نميكنيم. ما هرگز در آزمايشگاههاي خود ويروس را نداشتيم؛ ما به آن نيازي نداريم. تمام آنچه لازم است، اطلاعات ژنتيكي است.»
توليد واكسن RNA در مقايسه با واكسنهاي ديگر سريعتر و اين فناوري، دقيقتر و انعطافپذيرتر است. علاوهبراين، زيرساختهاي مورد نياز كوچك هستند و سريع آماده ميشود.
در حالت معمول، ساخت واكسنها معمولا چند دهه طول ميكشد؛ اما بهگفتهي زاكس و شاهين، چرخههاي ساخت سريع آنها از آنجا ناشي ميشود كه مراحل مختلف ساخت واكسن متوالي نيست و بهصورت موازي انجام ميشود. شاهين ميگويد: «قبل از اينكه بدانيم واكسن مؤثر است، در حال برنامهريزي براي كارآزمايي مرحلهي سوم و توليد واكسن بوديم.» زاكس در مورد تلاش شركتهاي ديگر براي ساخت واكسن كوويد، ميگويد: «در اينجا فقط دو رقيب داريم: ويروس و زمان. دنيا براي موفقيت به تلاش بيش از يك شركت نياز دارد.» شاهين با اين موضوع موافق است و به اهميت همكاري شركتها و مراكز مختلف اشاره دارد: «واقعا مهم است كه ببينيم مردم چگونه با هم همكاري ميكنند: مدرنا با NIH همكاري ميكند، ما با فايزر همكاري ميكنيم و آسترازنكا با دانشگاه آكسفورد به همكاري پرداخته است. ما بيشترين شفافيت را داريم. مردم شاهد دادهها در زمان واقعي هستند.»
نتايجي كه تاكنون حاصل شده، دلگرمكننده بوده است. بهعنوان مثال، براساس مشاهدات اوليهي پاسخهاي ايمني بيماران، مدرنا انتظار دارد واكسني با كارآيي بيش از ۶۰ درصد تحويل دهد. زاكس ميگويد: «اين كارآيي به اندازه كافي خوب است.زيرا اگر تعداد كافي از مردم مصونيت كسب كنند، سرانجام انتقال ويروس و در نهايت بيماري متوقف ميشود.»
وقتي از زاكس در مورد فشارهاي سياسي براي تحويل سريع واكسن سؤال شد، وي مصمم بود كه ايمني و كارآيي هرگز طي اين روند قرباني نخواهد شد. او گفت: «اين مسئلهي انساني است. همهي ما شاهد اتفاقاتي كه رخ ميدهد، هستيم. همهي ما بستگان يا همكاراني داريم كه تحت تأثير قرار گرفتهاند. همهي ما اين روزها در جهاني كاملا متفاوت زندگي ميكنيم. برخي از اعضاي گروه من هرگز قدم به ساختمان نگذاشتهاند و من هنوز نتوانستهام آنها را ملاقات كنم و با آنها دست بدهم. من در حال استفاده از مزيت دوركاري هستم؛ اما نميتوانم به مادر ۸۰ سالهام سر بزنم كه در كشور ديگري زندگي ميكند. اين بزرگترين فشار براي گروه من و افراد در حال فعاليت در اين حوزه است: اين احساس مسئوليت كه ميتوانيم اين وضعيت را تغيير دهيم.»
كيت آزمايشي كه ميتواند دوران پزشكي شخصي را تحقق بخشد
كريس تومازو، مديرعامل استارتاپ DnaNudge كه از اوايل حرفهي خود بهعنوان مهندس الكترونيك،در زمينه فناوري تلفن همراه متخصص بود، ميگويد:
سالهايي زيادي از دوران تحصيل دانشگاهي خود را صرف تلاش براي كوچك كردن دستگاهها به اندازهي تلفن همراه كردم. دوران خوشي من در عرصه پزشكي زماني آغاز شد كه يكي از اولين ايمپلنتهاي حلزون گوش را براي كودكاني كه ناشنوا متولد ميشوند، ساختيم. واضح بود كه اگر بخشي از اين فناوري را در مراقبتهاي بهداشتي به كار بگيريد، ميتوانيد نوآوريهاي بزرگي ايجاد كنيد.
تومازو با اختراع دستگاههاي پوشيدني كه ميتوانند علائم حياتي را نظارت كنند و آزمايش ژنتيكي انجام بدهند تا ببينند آيا دارويي توسط بيمار متابوليزه ميشود، تحولاتي ايجاد كرده است. تومازو ميگويد: «كل اين حوزه مرا نااميد ميكرد؛ زيرا پيشگيري هرگز به اندازهي درمان مهم نبود. هرگز مدلهاي تجاري براي پيشگيري وجود نداشت ... من فكر كردم بايد مصرفكننده را توانمند سازم تا آزمايش DNA را مردمي كنم.»
تومازو تصميم گرفت روي بيماريهاي مزمن شايع تمركز كند كه بيش از ۶۰ درصد از مردم را تحت تأثير قرار ميدهد: چاقي و وضعيتهاي مرتبط مانند ديابت و فشار خون بالا. وي با همكاري دانشگاه كمبريج ريزتراشهاي ساخت كه ميتوانست استعداد ژنتيكي ابتلا به ديابت نوع ۲، چاقي، فشار خون و كلسترول را تشخيص دهد كه همه با تغذيه در ارتباط هستند. تومازو در سال ۲۰۱۵ شركت DnaNudge را تأسيس و فروشگاهي در يكي از محلههاي لندن ايجاد كرد. شركت، دستگاه پوشيدني DnaBand را ساخت كه به مشتريان امكان ميداد محصولات سوپرماركتها را اسكن كنند و اطلاعاتي در مورد اينكه آيا آن محصولات با بيولوژي آنها سازگار است، دريافت كنند. تومازو گفت: «ما تمام درشتمغذيهاي مرتبط با هر محصولي كه در سوپرماركتهاي بريتانيا يافت ميشود، در نظر گرفتهايم. اين بدان معنا است كه اساسا ميتوانيد بر اساس DNA خود خريد كنيد.» فناوري مذكور همراه با كارتريجي به نام DnaCartridge و كيت آزمايش NudgeBox كار ميكند. وي توضيح داد: «روي كارتريج، آرايه قرار گرفته است و روي آرايه، چاهكهاي كوچكي وجود دارد. درون چاهكها طعمه (آشكارگر خطاهاي ژنتيكي در ژنوم) را قرار ميدهيم. در اين آزمايش، كاربر با سواب (نمونهگير) از گونهي خود نمونهاي تهيه ميكند كه درون كارتريج قرار داده ميشود و درون جعبه جاي ميگيرد. در اينجا DNA از نمونه استخراج و تجزيهوتحليل ميشود.»

در مارس ۲۰۲۰ وقتي كوويد ۱۹ بريتانيا را فرا گرفت، تامازو به اين فكر كرد كه چگونه فناوري او ميتواند به مبارزه با ويروس كرونا كمك كند. او ميگويد: «فكر كردم به جاي اينكه به خطاهاي ژنتيكي نگاه كنم، چرا به RNA ويروس (حاوي اطلاعات سنتز پروتئينها) نگاه نكنم؟ تنها كاري كه بايد انجام ميشد، جايگزيني طعمهاي براي تشخيص كوويد ۱۹ بود.»
نتيجهي اين تلاش، آزمايش COVID Nudge بود كه آزمايش كوويد بدون نياز به آزمايشگاه است. آزمايش مذكور مبتني بر واكنش زنجيرهاي پليمراز (PCR) است و طي حدود يك ساعت نتيجه آن مشخص ميشود و به آزمايشگاه نياز ندارد. تامازو و گروهش COVID Nudge را به بيمارستانها بردند تا دقت آن را ارزيابي كنند و آن را روي ۴۰۰ بيمار آزمايش كردند. در مقالهاي كه در مجله لنست منتشر شد، گزارش شد متوسط حساسيت آزمايش ۹۵ درصد و ويژگي آن نزديك به ۱۰۰ درصد است. تومازو معتقد است DnaNudge كاربردهايي در حوزههايي مانند تشخيص بيماريهاي مقاربتي و سرطانشناسي نيز پيدا خواهد كرد.
استفاده از يادگيري عميق براي بهبود رويههاي جراحي
اريك توپول، متخصص قلب از مؤسسه پژوهشي اسكريپس آمريكا، ميگويد: «پس از ۳۰ سال خواندن كارديوگرام، هرگز نميتوانم بگويم كارديوگرامي كه ميبينم، مربوط به زن يا مرد است يا اينكه سن شخص را مشخص كنم. اين در حالي است كه ماشين ميتواند تشخيص دهد كه آيا فرد دچار كمخوني است، اختلال عملكرد عضله قلب دارد يا تشخيصهاي دشواري مانند آميلوئيدوز يا كارديوميوپاتي هيپرتروفيك را انجام دهد.»
توپول نهتنها از توانايي ماشينها در تشخيص مشكلات بهتر از متخصصان، بلكه از اينكه ميتوانند الگوهايي كشف كنند كه كارشناسان متوجه آن نميشوند هيجانزده است. او ميگويد: «در ژاپن، به جاي اعتماد به چشم متخصص گوارش، از دستگاهي براي برداشت پليپها در زمان واقعي با استفاده از بينايي ماشين و تشخيص اينكه آيا ممكن است سرطاني باشند يا نه و اينكه آيا بايد نمونهبرداري انجام شود يا نه، استفاده ميشود. ماشينها جايگزين پزشكان نخواهند شد؛ اما پزشكاني كه از هوش مصنوعي استفاده ميكنند، بهزودي جايگزين كساني ميشوند كه از آن استفاده نميكنند.»
بااينحال، هنوز روزهاي اوليه استفاده از هوش مصنوعي در زمينهي مراقبتهاي بهداشتي است. پيرس كين، چشمپزشك مشاور در بيمارستان چشم مورفيلدز لندن، همكاري مورفيلدز و گروه سلامت ديپمايند گوگل را رهبري كرده است. او در سال ۲۰۱۸، مقالهي اثبات مفهومي در مجلهي Nature منتشر كرد كه اولين تشخيص موفقيتآميز هوش مصنوعي را براي بيماري چشم نشان ميداد. كين ميگويد: «... در همين حين، اين مسئله كمي ناخوشايند است؛ زيرا واقعيت آن است كه هنوز بينايي ميليونها نفر را نجات ندادهايم. ما در نيمه راه مسير رسيدن به آن نقطه هستيم. الگوريتمي كه توسعه داديم، در حال حاضر استفادهي باليني ندارد؛ بنابراين ما در تلاش براي تكميل آن هستيم.»
كين به مطالعهي INSIGHT اشاره ميكند كه ارتباط بيماريهاي چشم با وضعيتهاي ديگري مانند ديابت و زوال عقل را مورد بررسي قرار ميدهد. او ميگويد: «ما از چشم بهعنوان دريچهاي براي ديدن ساير بدن استفاده ميكنيم. اين ايدهاي قديمي است؛ اما با استفاده از يادگيري عميق، اكنون ميتوانيم به تصويري از شبكيه چشم نگاه كنيم و بگوييم: مربوط به زني ۵۸ ساله است كه سيگاري نيست و ديابت ندارد، شاخص توده بدني او حدود ۲۵ درصد و فشار خون حدود ۱۵۰ روي ۸۵ است. براي من، اين حيرتآور است.»
مطالعهي INSIGHT در حال تجزيهوتحليل بيش از سه ميليون اسكن توموگرافي انسجام نوري (OCT) از حدود ۳۰۰ هزار بيمار در بيمارستان مورفيلدز است كه طي دورهي ۴۰ ساله گرفته شده. كين ميگويد: «ما اكنون براي افرادي كه در مورفيلدز داراي اسكن شبكيه هستند، ميدانيم كدام يك دچار حمله قلبي، آلزايمر يا ديگر علل زوال شده است. علت هيجان ما آن است كه فكر ميكنيم اگر بتوانيم دادههاي مناسبي جمع كنيم، با استفاده از يادگيري عميق، خواهيم توانست اطلاعات بيشتري در مورد سلامت ساير اعضاي بدن پيدا كنيم.»
هوش مصنوعي بر بيماران نيز تأثير ميگذارد و به آنها كمك ميكند سلامتي خود را مديريت كنند و مشكلات سلامتي خود را تشخيص دهند. اپل در سال ۲۰۱۸، اولين الگوريتم يادگيري عميق مورد تأييد سازمان غذا و دارو را براي مصرفكنندگان بهمنظور تشخيص فيبريلاسيون دهليزي از طريق ساعت هوشمند اپل ساخت. كاربردهاي ديگر هوش مصنوعي در زمينهي خودتشخيصي عفونت دستگاه ادراري، سرطان پوست و عفونت گوش است. توپول ميگويد: «كاربرد هوش مصنوعي براي مراقبتهاي بهداشتي و پزشكي فقط دقت نيست؛ بلكه صحت نيز هست. ما ميخواهيم پزشكي داشته باشيم كه اشتباهات كمتري داشته باشد؛ اما اين همهي آن نيست.»
از نظر توپول، مهمترين جنبه آن است كه هوش مصنوعي بتواند ارتباط انساني پزشك و بيمار را تقويت كند. او ميگويد: «پزشكان بيمار را به مدت بسيار كوتاهي ميبينند و اين كافي نيست. شما به زمان نياز داريد كه هوش مصنوعي ميتواند آن را به شما هديه كند تا افراد اينقدر احساس فشار نكنند.» آنچه توپول ميخواهد، آن است كه پزشكان زمان بيشتري با بيمار بگذرانند. براي مثال، با پردازش زبان طبيعي ميتوان مكالمات را ثبت و رونويسي كرد و به پزشكان اجازه داد به جاي نگاه كردن به صفحهكليد، زمان بيشتري صرف مشاهدهي بيمار كنند.
https://www.zoomit.ir/health-medical/366555-tech-is-reinventing-healthcare/
- ۶۱ بازديد
- ۰ نظر